


Resmetirom 作为首款获 FDA 批准的 NASH 疗法,确实为广大 NASH 患者带来了新的希望。全球 NASH 患者数量庞大,有数据显示,至 2030 年中国 NASH 患者将由 2016 年的 3260 万人增长至 4830 万人,美国 NASH 患者人数也将增长至 2700 万人。Resmetirom 的获批上市,填补了此前 NASH 治疗领域的市场空白,其销售峰值有望达到 55 亿美元。这不仅为 Madrigal Pharmaceuticals 公司带来了巨大的商业机遇,也为全球 NASH 治疗领域树立了新的里程碑。
在临床效果方面,Resmetirom 在 III 期临床达到了 FDA 提出的两个主要终点。与安慰剂组相比,Resmetirom 组患者在 NASH 缓解且无纤维化进展、纤维化改善同时 NAS 评分无恶化方面表现出色。关键次要终点方面,Resmetirom 组患者低密度脂蛋白胆固醇在 24 周较基线下降显著。然而,Resmetirom 也存在一些副作用,如腹泻和恶心等,但发生率高于安慰剂组的情况多为轻中度不良事件,整体安全性良好。研发难点方面,NASH 的病因非常复杂,涉及多条通路、多个靶点、多种细胞交叉相互作用,风险因素众多,这给药物研发带来了极大的挑战。
Resmetirom 为 NASH 治疗提供了新方向,其独特的作用机制和良好的临床效果有望引领多靶点联合治疗趋势。目前,全球范围内处于临床 Ⅲ 期的 NASH 治疗管线不到 10 个,这为 Resmetirom 创造了有利的市场环境。随着对 NASH 发病机制的深入研究和更多创新药物的研发,未来有望为 NASH 患者提供更加有效的治疗方案。同时,随着 GLP - 1 疗法在减重与糖尿病方面表现出显著疗效,行业也关注这类疗法用于治疗 NASH 的效果,许多相关试验也在开展,这将进一步丰富 NASH 的治疗手段。
全球 NASH 患者数量呈现不断上升的趋势。根据弗若斯特沙利文报告,2016 年到 2020 年,全球 NASH 患病人数从 3.1 亿人上升到 3.5 亿,并预计到 2030 年,全球 NASH 患病人数将达到 4.9 亿人。庞大的患者群体对 NASH 治疗药物产生了迫切的需求。NASH 的病因尚不完全清楚,但它通常与肥胖、甲状腺功能减退、糖尿病、高血脂等健康问题有关。随着全球肥胖和糖尿病等慢性疾病的流行,NASH 患者数量持续增长,为 NASH 药物市场提供了广阔的发展空间。
宏观经济环境对药企的 NASH 药物研发投入有着重要影响。一方面,随着全球经济的发展,人们对健康的关注度不断提高,医疗保健支出也在逐渐增加。这为药企加大对 NASH 药物的研发投入提供了经济基础。另一方面,NASH 药物市场的巨大潜力吸引了大量投资。据 Evercore ISI 分析师测算,Resmetirom 年销售额巅峰时期将超过 50 亿美元。弗若斯特沙利文预计,到 2030 年 NASH 药物市场规模将增长至 322 亿美元。巨大的市场潜力吸引了众多药企加大研发投入,以抢占市场份额。
Resmetirom 的获批对 NASH 药物行业产生了重大影响。在 Resmetirom 获批之前,NASH 药物研发被称为新药研发的 “黑洞”,多家国际巨头都经历失败,尚无公认有效的药物获批上市。Resmetirom 的获批为行业带来了曙光,标志着 NASH 治疗领域由研发进入商业化阶段。目前,NASH 药物行业呈现出活跃的研发态势,全球有上百种 NASH 药物在研,涉及近 20 种靶点。其中,较为热门的靶点包括 FXR、FGF21、GLP - 1R、PPAR、ASK1、THR - β 等。
Resmetirom 面临着来自其他 NASH 治疗药物及在研药物的竞争。目前,全球范围内处于临床 Ⅲ 期的 NASH 治疗管线不到 10 个,这些药物大多集中在热门靶点,有望在未来几年内填补 NASH 治疗市场的空白。例如,Akero 的 FGF21 类似物 Efruxifermin 和 Inventiva 的 PPAR 激动剂 Lanifibranor 已完成临床 2 期试验,均展现出比 Resmetirom 更好的纤维化改善能力及更大程度的肝脂肪含量降低。此外,同为 THR - β 激动剂的 VK2809 及 ASC41,以及 GLP - 1 激动剂司美格鲁肽和脂肪酸合成酶抑制剂 ASC40,都可以更好地改善肝部脂肪水平。
NASH 药物研发的新技术、新靶点不断涌现。THR - β 激动剂作为热门靶点之一,Resmetirom 是目前全球研发进度最快的药物。THR - β 在肝脏中高度表达,且 THR - β 激动剂被证实在人体中具有降低低密度脂蛋白(LDL)、甘油三酯(TG)和肝脏脂肪变性的活性。通过促进脂肪酸的分解和刺激线粒体的生物发生,THR - β 有助于减少脂肪毒性并改善肝功能,进而减少肝脏脂肪。除了 THR - β 激动剂,其他新靶点也在不断被发现和研究,如与 NASH 相关的新靶点包括 NTRK3、EphB2、CYR61 等。
NASH 患者对药物疗效、安全性及价格的需求不断变化。在疗效方面,患者希望药物能够有效缓解 NASH 症状,改善肝脏纤维化和脂肪含量。Resmetirom 在 III 期临床达到了 FDA 提出的两个主要终点,显示出一定的疗效,但仍有患者对其疗效有更高的期待。在安全性方面,患者希望药物的副作用尽可能小。Resmetirom 虽然整体安全性良好,但仍存在一些副作用,如腹泻和恶心等,这也促使药企在研发过程中更加注重药物的安全性。在价格方面,患者希望药物价格合理,能够负担得起。Resmetirom 每年治疗费用定价为 47400 美元,这对于一些患者来说可能是一个较大的经济负担。因此,药企在研发和定价过程中需要考虑患者的经济承受能力。
Resmetirom 作为甲状腺激素受体 THR-β 选择性激动剂,其作用原理主要在于甲状腺激素对许多生理过程有着重要影响,其中 THR-β 在肝脏中高度表达。Resmetirom 能被肝脏特异性摄取,激活肝脏中高表达的 THR-β。通过激活 THR-β,促进脂肪酸的分解和刺激线粒体的生物发生,有助于减少脂肪毒性并改善肝功能,进而减少肝脏脂肪堆积。同时,THR-β 激动剂被证实在人体中具有降低低密度脂蛋白(LDL)、甘油三酯(TG)和肝脏脂肪变性的活性。Resmetirom 具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的 THR-α 受体,并且在肝脏部位被特异性摄取,对骨骼或心脏参数无影响,同时不影响甲状腺激素通路的其它激素。
在临床试验中,Resmetirom 表现出色。对于 NASH 消退,与安慰剂组相比,Resmetirom 组患者在后期试验中表现出显着更高水平的 NASH 消退。具体而言,在第 52 周时,分别有 25.9% 与 29.9% 的 80mg、100mg Resmetirom 组患者实现 NASH 症状消除且肝纤维化未恶化,而安慰剂组中这一比例为 9.7%(P<0.001)。在肝纤维化改善方面,纤维化缓解至少 1 期且 NAS 评分没有加重的受试者比例也显著高于安慰剂组。80mg Resmetirom 组和 100mg Resmetirom 组患者分别有 24.2% 与 25.9% 实现了纤维化至少一个阶段的改善且 NAFLD 活动评分没有恶化,相较之下安慰剂组患者在此数值的比率仅有 14.2%(P<0.001)。在脂质指标方面,24 周用药后,Resmetirom 组 LDL-C 水平较基线显著下降,80mg 下降 13.6%,100mg 下降 16.3%,安慰剂组较基线几乎没有变化,52 周结果与 24 周结果基本一致。此外,利用基于核磁共振的无创检测手段对肝脏脂肪水平的评估显示,接受剂量为 100mg 的 Resmetirom 治疗 52 周后,患者肝脏脂肪水平平均降低 51%。肝纤维化、肝脏体积和脾脏体积也显著降低。
Resmetirom 常见的副作用有腹泻、恶心、瘙痒和呕吐等。其中,腹泻和恶心较为常见,但多为轻中度不良事件。对于这些副作用,可以采取一些应对措施。例如,在用药期间密切观察患者的症状,若出现副作用,可根据症状的严重程度调整用药剂量或给予相应的对症治疗。对于轻度的腹泻和恶心,可以给予饮食调整建议,如避免食用刺激性食物、增加膳食纤维的摄入等。对于较为严重的副作用,应及时停药并进行进一步的检查和治疗。同时,医生在用药前应充分告知患者可能出现的副作用,让患者有心理准备,并加强对患者的随访和监测,以便及时发现和处理副作用。
Resmetirom 作为全球首款获批的 NASH 治疗药物,具有独特的优势,但与其他已上市或在研的 NASH 治疗药物相比,也有其不足之处。
与其他 NASH 治疗药物相比,如 Akero 的 FGF21 类似物 Efruxifermin 和 Inventiva 的 PPAR 激动剂 Lanifibranor,虽然在纤维化改善能力及降低肝脂肪含量方面表现更好,但可能在其他方面存在不足。例如,这些药物可能在安全性、作用机制的特异性等方面不如 Resmetirom。同为 THR-β 激动剂的 VK2809 及 ASC41,以及 GLP-1 激动剂司美格鲁肽和脂肪酸合成酶抑制剂 ASC40,虽然可以更好地改善肝部脂肪水平,但在其他临床指标或安全性方面可能与 Resmetirom 存在差异。
未来可能有更多的企业进入 NASH 药物市场,对 Resmetirom 产生一定的影响。
总之,Resmetirom 在 NASH 治疗领域虽然取得了重大突破,但仍面临着来自现有竞争产品和潜在竞争对手的挑战。在未来的发展中,Madrigal Pharmaceuticals 公司需要不断优化产品,提高竞争力,以满足患者的需求。同时,整个 NASH 药物市场也将在竞争中不断发展壮大,为患者带来更多的希望。
FDA 对 Resmetirom 的批准是基于其亮眼的临床数据。Resmetirom 采用金标准肝穿刺验证,给药 52 周,达到了 NASH 缓解和纤维化改善两个组织学主要终点。具体而言,与安慰剂组相比,在接受 80mg 和 100mg Resmetirom 治疗 52 周的患者中,分别有 26% 和 30% 的患者实现 NASH 症状缓解;在接受 80mg 和 100mg Resmetirom 治疗 52 周的患者中,分别有 24% 和 26% 的患者实现至少一个阶段的纤维化改善,且 NAS 评分无恶化。
FDA 对 NASH 药物审批极为严格。除 NASH 发病机制复杂外,还在于其严格的临床终点认定:需要肝穿刺的病理学评价,影像学评价、血清学评价均不能作为上市审批的主要终点。若要取得病理学验证的成功,药企需要证明患者用药后至少满足以下一条标准:1)患者病理学评分(NAS)改善且肝纤维化无进展;2)患者肝纤维化改善且 NAS 评分无恶化。
不同国家对 NASH 药物的监管政策存在一定差异。例如,在印度,2020 年 3 月,Zydus Cadila 的 PPARα/PPARγ 双重激动剂 - Saroglitazar 获印度药物管理局批准,成为全球首个获批上市的 NASH 药物,但目前该药物未在美国,欧盟和日本等国家地区获批。
欧盟对 NASH 药物的审批也较为严格,目前 Resmetirom 在欧盟处于申请上市阶段。而在中国,NASH 药物市场同样具有巨大的发展潜力,但审批标准也较为严格。中国的监管部门注重药物的安全性和有效性,要求进行严格的临床试验和审批流程。
这些监管政策的差异对全球市场产生了重要影响。一方面,不同国家的审批标准不同,可能导致药物在不同国家的上市时间和市场准入情况不同。例如,Resmetirom 在美国获得 FDA 批准,但在其他国家可能需要更长的审批时间。另一方面,监管政策的差异也促使药企在研发过程中更加注重药物的质量和安全性,以满足不同国家的监管要求。同时,各国监管部门也在不断加强合作和交流,以促进全球 NASH 药物市场的健康发展。
学术研究在 Resmetirom 的研发及 NASH 治疗领域中发挥着至关重要的推动作用。从 Resmetirom 的研发历程来看,众多的学术研究为其提供了理论基础和技术支持。例如,对甲状腺激素受体 β 亚型的深入研究,揭示了其在肝脏代谢中的关键作用,为 Resmetirom 作为甲状腺激素受体 THR-β 选择性激动剂的研发提供了方向。
学术研究不仅在药物研发的前期阶段提供了理论支持,还在临床试验阶段为药物的有效性和安全性评估提供了科学依据。例如,通过对 NASH 患者的病理生理机制的研究,确定了肝穿刺验证作为金标准,为 Resmetirom 的临床数据提供了可靠的评价方法。
此外,学术研究还促进了不同领域之间的合作与交流。在 NASH 治疗领域,涉及到医学、生物学、化学等多个学科领域,学术研究为这些领域的专家提供了交流合作的平台,共同推动 NASH 治疗技术的创新和发展。
行业合作在 NASH 治疗领域同样具有重要意义。不同的药企、科研机构之间的合作可以整合资源,提高研发效率。例如,Madrigal Pharmaceuticals 公司可以与其他药企合作,共同开展临床试验,分享研发经验,降低研发成本。
行业合作还可以促进技术的交流与创新。不同的企业可能在药物研发的不同环节具有优势,通过合作可以实现优势互补,共同攻克技术难题。例如,在 Resmetirom 的研发过程中,Madrigal Pharmaceuticals 公司可以与生物技术公司合作,利用其先进的生物技术提高药物的疗效和安全性。
患者教育对提高 NASH 药物市场认知度具有重要影响。NASH 作为一种较为复杂的疾病,患者对其了解程度往往较低。通过患者教育,可以提高患者对 NASH 的认识,了解疾病的危害和治疗方法,促进患者积极参与治疗。
患者教育可以提高患者对 NASH 药物的认知度。通过向患者介绍不同的 NASH 药物,包括 Resmetirom 等,让患者了解药物的作用机制、疗效和副作用,帮助患者做出明智的治疗选择。
患者教育还可以增强患者的治疗依从性。通过向患者讲解药物的正确使用方法、注意事项等,提高患者对治疗的重视程度,增强患者的治疗依从性,提高治疗效果。
为了提高患者教育的效果,可以采取多种方式。例如,可以通过举办患者教育讲座、发放宣传资料、开展在线教育等方式,向患者普及 NASH 知识和治疗方法。同时,医生在日常诊疗过程中也应该加强对患者的教育,提高患者的疾病认知和治疗依从性。
总之,学术研究和行业合作对 Resmetirom 的研发及 NASH 治疗领域的发展具有重要推动作用,而患者教育则可以提高 NASH 药物市场认知度,促进患者积极参与治疗。这些因素共同作用,将为 NASH 患者带来更多的希望和福祉。
Resmetirom 的研发过程面临诸多风险。临床试验失败是一个主要风险,尽管目前 Resmetirom 在临床试验中取得了一定的成果,但后续的研究仍可能出现意外情况。例如,在扩大样本量或长期随访过程中,可能发现新的副作用或疗效不如预期。据统计,新药研发的成功率通常较低,只有约 10% 的药物能够最终成功上市。
技术难题难以突破也是一个潜在风险。NASH 的发病机制复杂,涉及多个生理过程和信号通路。Resmetirom 作为甲状腺激素受体 THR-β 选择性激动剂,虽然在一定程度上改善了 NASH 症状,但对于一些严重的患者可能效果有限。此外,药物的研发需要不断优化配方和生产工艺,以提高药物的稳定性和生物利用度。如果在技术上无法取得突破,可能会影响药物的质量和疗效。
竞争加剧是 Resmetirom 面临的主要市场风险之一。随着 NASH 药物市场的不断扩大,越来越多的企业将进入这个领域。目前,全球范围内处于临床 Ⅲ 期的 NASH 治疗管线不到 10 个,这些药物大多集中在热门靶点,未来几年内可能会有更多的药物获批上市。例如,Akero 的 FGF21 类似物 Efruxifermin 和 Inventiva 的 PPAR 激动剂 Lanifibranor 已完成临床 2 期试验,均展现出比 Resmetirom 更好的纤维化改善能力及更大程度的肝脂肪含量降低。同为 THR-β 激动剂的 VK2809 及 ASC41,以及 GLP - 1 激动剂司美格鲁肽和脂肪酸合成酶抑制剂 ASC40,也在不断挑战 Resmetirom 的市场地位。
市场需求变化也是一个潜在风险。NASH 的发病率与肥胖、糖尿病等慢性疾病密切相关,随着人们生活方式的改变和医疗技术的进步,这些疾病的发病率可能会发生变化,从而影响 NASH 的市场需求。此外,患者对药物的疗效、安全性和价格的需求也在不断变化。如果 Resmetirom 不能满足患者的需求,可能会被市场淘汰。
监管政策变化对 Resmetirom 的市场前景有着重要影响。FDA 对 NASH 药物的审批极为严格,除 NASH 发病机制复杂外,还在于其严格的临床终点认定:需要肝穿刺的病理学评价,影像学评价、血清学评价均不能作为上市审批的主要终点。如果未来监管政策进一步收紧,可能会增加 Resmetirom 的研发成本和时间,甚至导致药物无法获批上市。
不同国家对 NASH 药物的监管政策存在一定差异,这也给 Resmetirom 的市场推广带来了一定的挑战。例如,在印度,Zydus Cadila 的 PPARα/PPARγ 双重激动剂 - Saroglitazar 获印度药物管理局批准,成为全球首个获批上市的 NASH 药物,但目前该药物未在美国,欧盟和日本等国家地区获批。如果不同国家的监管政策不能协调一致,可能会影响 Resmetirom 的全球市场布局。
瑞美替罗Resmetirom关键中间体(化工级、纯度≥99.0%),目前我公司均有供应。【自有合规工厂,全面支持验厂审计】详情可以拨打最下方系电话,获取该产品最新价格!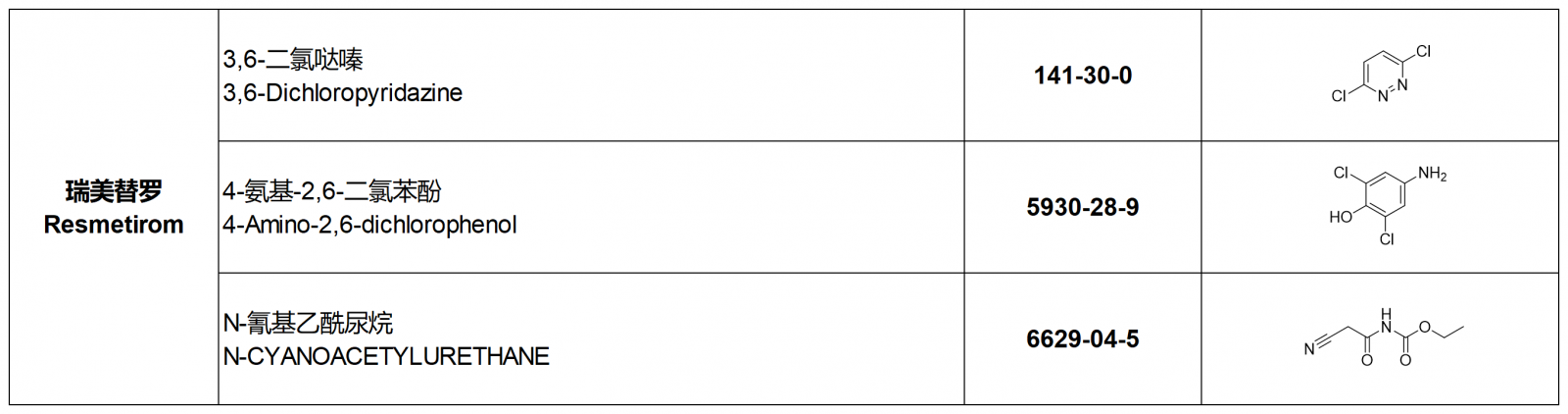
--------------------
3,6-二氯哒嗪
3,6-Dichloropyridazine
141-30-0
--------------------
4-氨基-2,6-二氯苯酚
4-Amino-2,6-dichlorophenol
5930-28-9
--------------------
N-氰基乙酰尿烷
N-CYANOACETYLURETHANE
6629-04-5
--------------------
注意:受有效专利保护的产品不得用于商业用途。如有相关法规允许,此类产品可用于研究与注册申报。管制产品将严格遵守中国法律和购买客户国法律的规定销售,所有产品都不适用于人用,买方应对各自市场的专利情况进行独立评估,并承担所有与专利相关的责任。
编辑|小鑫
审核|小晶 小李
信息来源 | Chatgpt AI、FDA、Wikipedia、国家医疗保障局、百度百科
图片来源 | fda.gov
如有侵权,道歉删除,如有错误,欢迎批评指正
在任何情况下,本文中的信息或表述的意见,仅供参考,均不构成对任何人的投资建议